Química
Alguns conteúdos sempre estão presentes em provas do ENEM.
Sugestão de alguns deles.
Equilíbrios Químicos
O equilíbrio químico existe em reações químicas
reversíveis, ou seja, que podem ocorrer no sentido direto e no sentido
inverso. O equilíbrio químico é chamado de equilíbrio dinâmico porque a reação continua
acontecendo, mas a velocidade da reação direta e da reação inversa é a
mesma. É importante estudar, também, equações de equilíbrio químico e constante
de ionização.
Um equilíbrio químico é a situação em que a
proporção entre os reagentes e produtos de uma reação química se mantém
constante ao longo do tempo.
Um equilíbrio químico se faz presente onde reações diretas e inversas ocorrem simultaneamente. Esses sistemas são denominados reversíveis e representados por  .
.
A seta com sentidos duplos indica que a reação está em equilíbrio, ou seja, ela pode ocorrer tanto da esquerda para a direita (reação direta), como da direita para esquerda (reação inversa). A seguir temos um exemplo prático dessa reação.
A água líquida entra em equilíbrio químico quando é armazenada em recipiente fechado.
Vd = velocidade de vaporização.
Vi = velocidade de condensação.
Vi = velocidade de condensação.
O processo é reversível dentro do frasco fechado: as moléculas de água passam continuamente do estado líquido para o vapor (representado por Vd) e do vapor para o líquido (Vi).
O instante exato de equilíbrio é quando a velocidade de vaporização (Vd) fica igual à de condensação (Vi). Acompanhe o gráfico que representa esse e outros equilíbrios:
Uma consequência importante do fato de as duas velocidades serem iguais na situação de equilíbrio é que a quantidade dos reagentes e produtos permanece constante.
A tabela a seguir demonstra uma reação reversível, do início até o estabelecimento do equilíbrio, onde o tempo é dado em segundos:
.jpg)
Nas reações químicas reversíveis, a velocidade inicial (t=0) da reação direta é máxima, pois a concentração em mol/L do reagente também é máxima. Com o passar do tempo, a velocidade da reação direta diminui, ao passo que a velocidade da inversa aumenta, é o que podemos observar passados 20 segundos (nesse instante temos uma maior quantidade de produtos).
Somente decorridos 30 segundos do começo da reação teremos o equilíbrio químico, daí então ele permanece constante até o fim do processo.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Química Orgânica
Os compostos orgânicos estão presentes em diversas situações
do cotidiano, em objetos de plástico, fibras de tecidos, frutas, combustíveis,
sabonetes, bebidas alcoólicas, e outros. Por isso, o Enem adora este
assunto de química. Os compostos orgânicos possuem átomos de
hidrogênio (H) e oxigênio (O), que podem ser representados por um simples
traço (_). Estude as principais características dos compostos orgânicos, suas
reações químicas, e saiba identificar as funções orgânicas (alcoóis,
fenóis, éteres, ésteres, etc.).
Esta parte da química estuda a estrutura, propriedades, composição, reações e síntese de compostos orgânicos que, por definição, contenham carbono, mas que podem também conter outros elementos, como o oxigênio e o hidrogênio. Muitos deles contêm nitrogênio, halogênios e, mais raramente, fósforo e enxofre.
A Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.
Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica.
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
Visto que o carbono é tetravalente, podendo realizar quatro ligações de diferentes maneiras, com átomos de outros elementos ou com átomos do próprio carbono, existem milhões de seus compostos. Uma quantidade muito superior do que a de compostos inorgânicos conhecidos atualmente.
Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros.
Veja nesta subseção como identificar cada uma dessas funções, onde elas estão presentes em nossa sociedade, a realizar a nomenclatura dos compostos orgânicos segundo as regras estabelecidas pela IUPAC, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.

As funções oxigenadas abrangem compostos orgânicos formados por átomos de carbono, hidrogênio e oxigênio. Esses átomos se ligam de diferentes maneiras formando uma infinidade de cadeias carbônicas, e por isso, esse é um grupo enorme e bastante diversificado de compostos.
Todas essas substâncias são classificadas nos seguintes grupos funcionais:
* Alcoóis: Possuem uma hidroxila (−OH) ligada a um carbono saturado;
* Fenóis: Possuem uma hidroxila (−OH) ligada a um carbono pertencente a um anel benzênico;
* Enóis: Possuem uma hidroxila (−OH) ligada a um carbono insaturado;
* Aldeídos: Possuem o grupo carbonila (C ? O) ligado a um hidrogênio;
* Cetonas: Possuem o grupo carbonila (C ? O) entre dois carbonos;
* Ácidos carboxílicos: Possuem o grupo carbonila (C ? O) ligado a uma hidroxila;
* Ésteres: São formados pela troca de um hidrogênio da carboxila dos ácidos carboxílicos por algum grupo alquila ou arila;
* Éteres: Possuem o oxigênio entre dois carbonos.
Existem compostos oxigenados que são naturais e estão presentes em processos metabólicos importante, tais como o açúcar, a glicerina, o colesterol e o amido. E existem também compostos orgânicos presentes em produtos utilizados no cotidiano, como perfumes, plásticos, combustíveis (como o etanol mencionado na figura acima), essências, entre outros. Esses compostos possuem grande importância econômica, pois participam de muitas reações realizadas em indústrias para a produção de diversos materiais.
Fontes:
http://mundoeducacao.bol.uol.com.br/quimica
https://geekiegames.geekie.com.br/
http://meioambiente.culturamix.com/
brasilescola.uol.com.br/
http://educacao.globo.com/quimica/
https://pt.wikipedia

Eletroquímica
A eletroquímica é a parte da química que estuda transferências de elétrons entre substâncias. Reações onde alguns reagentes perdem elétrons enquanto outros ganham para formar produtos são chamadas reações de oxirredução ou redox. O comportamento dessas reações é o principal tópico da eletroquímica.
Numa reação de oxirredução ocorrem dois processos básicos: a perda de elétrons chamada de oxidação e o ganho de elétrons chamado de redução. Se uma substância sofre redução ela causa, consequentemente, a oxidação de outra substância, portanto ela atua como um agente oxidante. Da mesma forma uma substância que foi oxidada atuou como agente redutor. Temos que:
Agente oxidante ⇔ Sofre redução ⇔ Ganha elétrons
Agente redutor ⇔ Sofre oxidação ⇔ Perde elétrons
A identificação de reações redox nem sempre é óbvia. Em geral associamos reações de transferência de elétrons com reações dentro de pilhas e baterias, entretanto reações redox são mais comuns do que imaginamos. A combustão, respiração, ferrugem são alguns exemplos de processos de oxirredução. Para identificar se uma reação é de oxirredução é necessário avaliar a variação do número de oxidação (Nox) dos produtos e reagentes. Em geral atribui-se um número de oxidação para cada átomo nos reagentes e cada átomo dos produtos. Caso ocorra variação concluímos que houve transferência de elétrons e portanto a reação é de oxirredução. Por exemplo considere as seguintes reações:
No primeiro caso o número de oxidação de substância simples é zero, para íons mononucleares o Nox é igual a carga. Temos que o Nox do zinco variou de 0 para +2 enquanto que o Nox do hidrogêniovariou de 0 para +1. Portanto trata-se de uma reação redox. Já no segundo todos os átomos mantiveram seus números de oxidação constante, logo não trata-se de uma reação redox.
As reações redox estão associadas com uma energia potencial relacionada ao deslocamento dos elétrons de uma espécie para outra. Podemos calcular a força eletromotriz ou diferença de potencial de uma reação redox da seguinte forma:
Ou seja, a diferença potencial é igual a diferença dos potenciais padrão de redução do agente redutor e do agente oxidante. Os potenciais padrão de redução são obtidas a partir de uma referência, em geral o eletrodo padrão de hidrogênio. Com os valores tabulados é possível prever a espontaneidade de reações de oxirredução onde uma diferença de potencial positiva indica um processo espontâneo e uma diferença de potencial negativa indica um processo forçado ou não espontâneo. Por exemplo:
A primeira reação ocorre espontaneamente uma vez que o potencial é positivo, podendo ser uma pilha ou célula voltaica. A segunda reação por outro lado tem um potencial negativa, logo não ocorre naturalmente, para realizá-la é necessário fornecer corrente elétrica num processo chamado eletrólise.
Referência:
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
A Eletroquímica é um ramo da Química que estuda o fenômeno da transferência de elétrons para a transformação de energia química em energia elétrica e vice-versa.
As reações que envolvem transferência de elétrons são chamadas de reações de oxirredução, pois nelas ocorrem simultaneamente a redução e a oxidação. A espécie química que perde elétrons passa por uma oxidação e fica com o Nox (número de oxidação) maior. Já a espécie química que recebe esses elétrons passa por uma redução e o seu Nox fica menor.
Por exemplo, a seguir há uma reação desse tipo, na qual uma placa de zinco metálico (Zn0) é colocada em uma solução de sulfato de cobre (que possui cátions cobre II (Cu2+) dissolvidos). O zinco sofre oxidação, perdendo dois elétrons e transformando-se no cátion zinco (Zn2+), enquanto os íons cobre recebem esses elétrons e transformam-se em cobre metálico (Cu0). Veja a equação iônica desse processo:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Assim, nos fenômenos eletroquímicos, sempre ocorrem reações semelhantes a essa. Porém, isso pode ocorrer de duas formas. Os dois campos de estudo principais da Eletroquímica são:
* Pilhas e baterias: Nesse caso existe a conversão de energia química em energia elétrica, ou seja, usam-se as reações químicas de oxirredução espontâneas para a geração de eletricidade.
Dentro das pilhas são colocadas certas substâncias químicas que reagem espontaneamente transferindo elétrons, isto é, por meio de reações de oxirredução. As pilhas possuem dois eletrodos, que são:
- ânodo: polo negativo onde ocorre a oxidação;
- cátodo: polo positivo onde ocorre a redução.
As pilhas e baterias também possuem um eletrólito, que é uma solução condutora de íons. Assim, forma-se um fluxo de elétrons entre esses polos que resulta na formação de uma corrente elétrica que pode ser utilizada para que diversos aparelhos elétricos funcionem.
A diferença entre as pilhas e as baterias é que enquanto as pilhas possuem somente dois eletrodos, as baterias são formadas por várias pilhas conectadas em série ou em paralelo, ou seja, possuem vários eletrodos, o que aumenta a sua voltagem.
O que seria de nossa sociedade sem as pilhas e as baterias que fazem funcionar os celulares, os carros, os relógios e muitos outros aparelhos?

Exemplos de baterias (de celulares e de automóveis) usadas no cotidiano
* Eletrólise: É o processo inverso que ocorre nas pilhas e baterias, ou seja, ocorre a transformação de energia elétrica em energia química. Utiliza-se energia elétrica para forçar a ocorrência de uma reação química não espontânea pela neutralização das cargas dos íons e formação de substâncias simples.
Isso ocorre quando se passa uma corrente elétrica proveniente de algum gerador (como uma pilha ou uma bateria) por um líquido iônico (substância fundida - eletrólise ígnea) ou por uma solução aquosa que contém íons (eletrólise em meio aquoso). Desse modo, o cátion presente no líquido ou na solução recebe elétrons, e o ânion doa elétrons, para que ambos fiquem com carga elétrica igual a zero e com energia química acumulada.
A eletrólise é usada para a produção de substâncias simples de uso importante que não são encontradas na natureza, como o gás cloro e o sódio metálico produzidos na eletrólise ígnea do cloreto de sódio. Na eletrólise aquosa do cloreto de sódio, além de o cloro ser produzido, também se obtém o gás hidrogênio que é usado como combustível. Mais detalhes sobre como ocorrem esses processos podem ser vistos no texto Eletrólise do cloreto de sódio.
Eletrólise aquosa do cloreto de sódio com produção de cloro e hidrogênio
A eletrólise também é usada para a produção de metais, como mostra o artigo Produção de alumínio por eletrólise, e para o desenvolvimento de processos de proteção de metais contra a corrosão.
A Eletroquímica é, portanto, um ramo muito importante não só porque está relacionada com o desenvolvimento tecnológico e de métodos de produção de eletricidade, mas também porque permite inclusive a monitoração das atividades do cérebro e do coração, do pH do sangue, da presença de contaminantes na água, além de possibilitar a criação de equipamentos que salvam vidas, como o marcapasso, e assim por diante.

As baterias dos automóveis são baterias de chumbo, que geram normalmente 12 volts
- Eletrólise:
A eletrólise é o processo inverso das pilhas e baterias, isto é, uma corrente elétrica gera uma reação química de oxidorredução. A eletrólise é um processo não espontâneo que transforma energia elétrica em energia química.
Existem dois tipos de eletrólises:
* Eletrólise ígnea: é feita com ausência de água. A corrente elétrica passa pela substância iônica na fase líquida (fundida). Um exemplo é a eletrólise do cloreto de sódio (sal de cozinha) fundido, que produz o gás cloro e o sódio metálico.
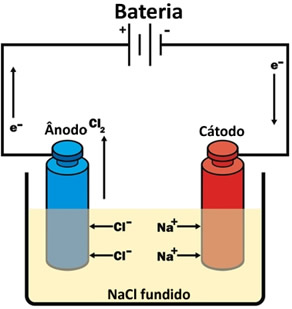
Eletrólise ígnea do cloreto de sódio (sal de cozinha)
* Eletrólise em meio aquoso: nesse caso temos íons fornecidos pela substância dissolvida na água. Um exemplo da utilização da eletrólise é no revestimento de peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
No exemplo abaixo, temos a cobreação de uma chave, ou seja, por meio da eletrólise de uma solução aquosa de sulfato de cobre, a chave será revestida de cobre:
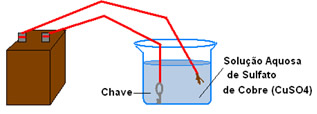
Esquema de cobreação de uma chave
Por Jennifer Fogaça
Graduada em Química
Fontes :http://www.infoescola.com/quimica/eletroquimica/
http://mundoeducacao.bol.uol.com.br/quimica/
http://manualdaquimica.uol.com.br/fisico-quimica
Pesquisa e organização da postagem Profª Lourdes Duarte.
Queridos alunos, aprofundem conhecimentos nestes conteúdos, são importantes, bons estudos.





Nenhum comentário:
Postar um comentário